İyonlar, evrenin en temel yapı taşlarından biri olan atomların elektron kazanması ya da kaybetmesiyle oluşan yüklü parçacıklardır. Gündelik hayatımızdan yıldızlara kadar her yerde karşımıza çıkan iyonlar, maddenin kimyasal ve fiziksel özelliklerini anlamamız açısından kritik bir rol oynar.
İyon Nedir? Temel Tanım
Bir atom normalde nötr durumdadır; yani çekirdekteki pozitif yüklü proton sayısı ile elektron sayısı birbirine eşittir. Ancak atomlar bazı durumlarda elektron kaybeder veya kazanır.
-
Elektron kaybeden atomlar pozitif yüklü iyon yani katyon haline gelir.
-
Elektron kazanan atomlar ise negatif yüklü iyon yani anyon haline gelir.
Kısaca: İyon = Yüksüz atomun elektron alışverişi sonucu yük kazanmış hâli.
Atomdan İyona Geçiş: Elektronların Rolü
Atomlar, dış kabuklarındaki elektronların kararlı bir enerji düzeyine ulaşma eğilimi içindedir. Bu durum, soygaz kararlılığı ya da oktete ulaşma kuralıdır.
-
Örneğin sodyum (Na) atomu 1 elektron vererek +1 yüklü bir katyon (Na⁺) haline gelir.
-
Klor (Cl) atomu ise 1 elektron alarak -1 yüklü bir anyon (Cl⁻) olur.
Bu elektron alışverişi, iyonik bağ oluşumunun da temelini oluşturur.
İyon Türleri
İyonlar oluşum şekillerine ve yüklerine göre iki ana kategoriye ayrılır:
1. Katyonlar (Pozitif Yüklü İyonlar)
-
Elektron kaybeden atomlardan oluşur.
-
Çekirdekteki proton sayısı elektron sayısından fazladır.
-
Pozitif elektrik yükü taşırlar.
-
Metal elementler genellikle katyon oluşturur.
-
Örnek: Na⁺ (Sodyum), Ca²⁺ (Kalsiyum), Fe²⁺ (Demir).
-
2. Anyonlar (Negatif Yüklü İyonlar)
-
Elektron kazanan atomlardan oluşur.
-
Elektron sayısı proton sayısından fazladır.
-
Negatif elektrik yükü taşırlar.
-
Ametal elementler genellikle anyon oluşturur.
-
Örnek: Cl⁻ (Klor), O²⁻ (Oksijen), S²⁻ (Kükürt).
-
İyonların Oluşum Süreci
İyonlar yalnızca laboratuvar ortamında değil, doğada da sürekli oluşur. Aşağıda bu süreçlerin başlıcaları yer alır:
-
Kimyasal Reaksiyonlar: Atomlar elektron alışverişi yaparak iyonlaşır.
-
Işıma ve Enerji Alımı: Yüksek enerjili fotonlar bir elektronu atomdan koparabilir.
-
Isı ve Plazma Ortamları: Yüksek sıcaklıklarda atomların iyonlarına ayrılma ihtimali var.
-
Elektroliz: Elektrik akımıyla iyonlaşma sağlanabilir.
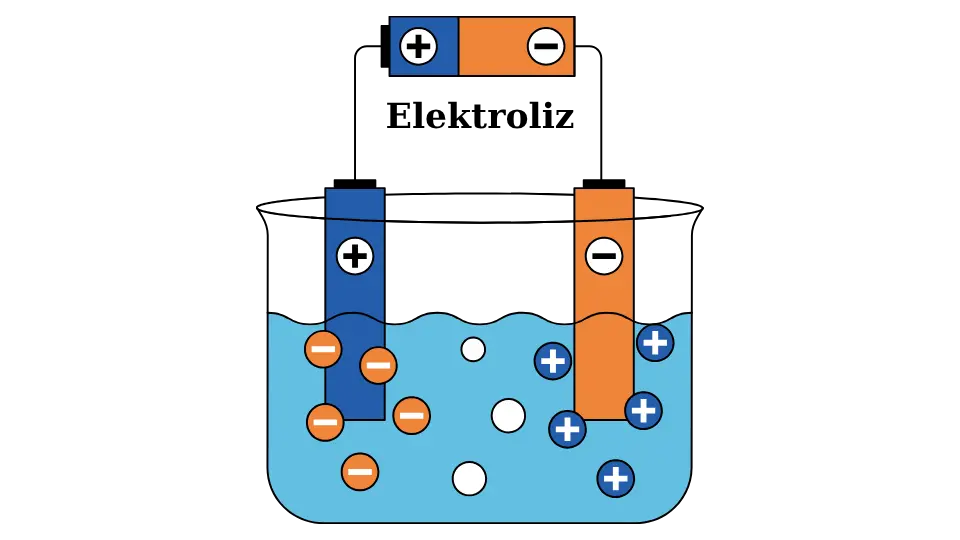
İyonların Doğadaki ve Teknolojideki Önemi
İyonlar sadece bilimsel teorilerde değil, gündelik yaşamda ve yüksek teknoloji alanlarında da önemli bir yere sahiptir:
-
Doğada: İyonlar, deniz suyunda, atmosferde ve hatta canlıların hücrelerinde bulunur.
-
Canlı Sistemleri: Sinir iletiminde sodyum (Na⁺) ve potasyum (K⁺) iyonları kritik rol oynar.
-
Endüstride: Pil teknolojilerinde iyonların hareketi elektrik üretimini sağlar.
-
Hava Temizleyiciler: Negatif iyonlar, hava kalitesini artırmak için kullanılır.
- Uzay Bilimi: Güneş rüzgarları ve plazma durumları iyonlardan oluşur. Ayrıca Güneş rüzgarındaki iyonlar, Dünya’nın manyetik alanıyla etkileşime girerek aurora (kutup ışıkları) oluşturur.
İyonlar ve İyonik Bağlar
İyonlar, zıt yüklerin birbirini çekmesiyle bir araya gelerek iyonik bileşikler oluştururlar.
-
Örneğin, Na⁺ ve Cl⁻ iyonları birleşerek Sodyum klorür (sofra tuzu) haline gelir.
-
Bu bağ oldukça güçlüdür ve birçok katı kristal yapı bu şekilde oluşur.
Sonuç: İyonlar Evrendeki Düzeni Anlamamızda Anahtar
İyonlar, atom fiziğinin ve kimyanın merkezinde yer alır. Onlar sayesinde:
-
Maddenin elektriksel özelliklerini,
-
Kimyasal reaksiyonların nasıl gerçekleştiğini,
-
Evrenin temel yapılarını anlamak mümkün olur.
Gündelik yaşamdan yıldızlara kadar her yerde var olan iyonlar, evrenin görünmez ama belirleyici mimarlarıdır.





